Ecuación de estado, variables termodinámicas
- Las moléculas de un gas ideal no se atraen o repelen entre ellas. Suponemos que las únicas interacciones de las moléculas que componen un gas ideal son las colisiones elásticas entre ellas y con las paredes del contenedor.
- Las móleculas de un gas ideal, en sí mismas, no ocupan volumen alguno. El gas tiene volumen, ya que las moléculas se expanden en una gran región del espacio, pero las moléculas de un gas ideal son aproximadas por partículas puntuales que en sí mismas no tienen volumen.
Ley de Gay-Lussac
Corresponde a las transformaciones que sufre un gas ideal cuando el volumen permanece constante.


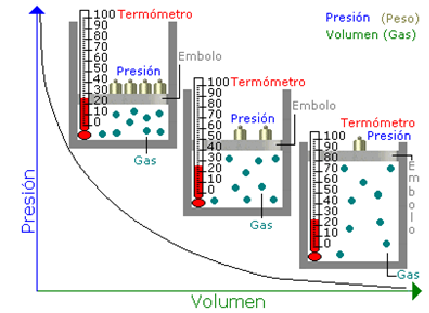
Ley de Boyle
Corresponde a las transformaciones que experimenta un gas cuando su temperatura permanece constante.

La curva que describe el gráfico P versus Volumen, corresponde a una isotérmica, es decir a todos los puntos donde la temperatura es la misma.
Ley de Avogadro
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas.


Donde:
P= es la presión del gas
V = el volumen del gas
n= el número de moles
T= la temperatura del gas medida en Kelvin
R= la constante de los gases ideales.
PREGUNTAS
•¿Es posible que dos objetos estén en equilibrio térmico si no están en contacto mutuo? Explique
No es necesario que dos cuerpos estén en contacto, para que estén en equilibrio termico. mientras esten los dos a la misma temperatura estarán en equilibrio termico.
•El péndulo de cierto reloj se fabrica de latón. Cuando la temperatura aumenta,¿el periodo del reloj aumenta, disminuye o permanece igual? Explique
El latón a medida que aumenta la temperatura se expande gracias a la dilatación por lo tanto la longitud del péndulo aumentara, y también aumenta el momento de inercia del péndulo Dado que el momento de inercia es proporcional, el periodo y la distancia se encuentran en una relación inversamente proporcional por lo tanto el periodo aumentaría, y el reloj correría lento.







Comentarios
Publicar un comentario